Riesgos que dejas de asumir contratando una CRO
Los que ya están familiarizados con las siglas CRO probablemente no necesiten una aclaración de a qué hacen referencia, pero nos gusta empezar nuestros posts con lo que creemos debería ser el principio. CRO es el acrónimo de Contract Research Organization y hace referencia a las Empresas de Investigación por Contrato que, desde hace varias décadas, han sido un modelo de negocio de apoyo para la industria farmacéutica.
¿Qué es una CRO o Organización de Investigación por Contrato?
Las CRO son organizaciones que proporcionan asistencia a través de la gestión y el desarrollo de ensayos clínicos a promotores de la Investigación Clínica (industria farmacéutica, de biotecnología y dispositivos médicos). Aportando especialización, experiencia y conocimiento en este nicho, aseguran que los ensayos son realizados de acuerdo con las normas éticas y metodológicas que permitan cumplir la normativa vigente y los estándares de calidad.
Esta especialización es garantía de la veracidad y trazabilidad de los resultados obtenidos, factor imprescindible a la hora del registro y comercialización de una vacuna o cualquier otro tratamiento.
Los promotores subcontratan a las CROs para realizar y supervisar los proyectos de investigación clínica de manera que:
Gestionar estudios clínicos es una tarea compleja que requiere de una muy buena organización para asegurar que todas las fases son ejecutadas según lo establecido en el protocolo. Intervienen multitud de actores: fabricantes, promotores, CROs, comités éticos, Autoridades reguladoras, Investigadores, centros de investigación, …) y en todo momento se debe trabajar bajo las normas de calidad establecidas que aseguren la validez del estudio. Las CROs son un apoyo en esta labor, ya que se encargan de la gestión integral del proyecto y actúan como interlocutoras entre las diferentes partes involucradas.
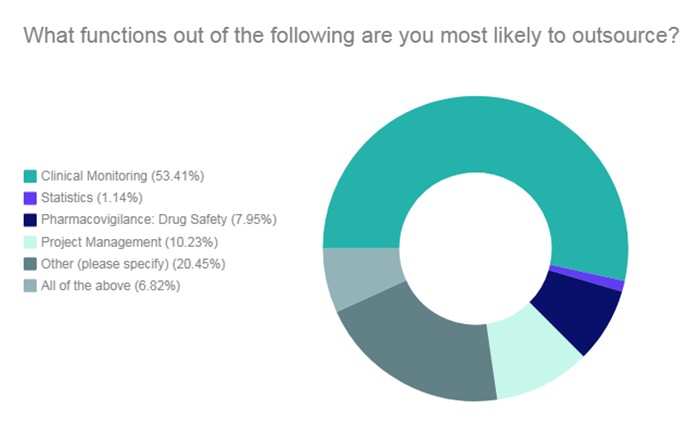
Según un estudio realizado por Pharma IQ las tareas que más suelen externalizarse a las CRO son (ordenadas de mayor a menor puntuación): Monitorización, “otros”, gestión del proyecto, farmacovigilancia, todas ellas y servicios de estadística.
Cumplimiento de los estándares de calidad ISO y Las Buenas Prácticas Clínicas y Guías de Armonización (GCP-ICH Guidelines)
Todo ensayo (clínico, nutricional, …) debe ser realizado cumpliendo con las normas BPC (Buenas Prácticas Clínicas) del programa VICH que aseguran el desarrollo de datos fiables y la mejora y protección de la salud humana, animal y del medio ambiente, así como el seguimiento de los estándares ISO que sientan las bases de la gestión de la calidad.
Las CRO deben asegurar que se cumplen todos los requisitos durante la ejecución de los ensayos clínicos
- Correcto diseño del protocolo
- Seguimiento de un método riguroso y ético
- Cumplimiento con las Norma ética y legal
- Veracidad de la Información
- Trazabilidad de la Información
- Calidad de la Información
- Difusión de los Resultados
Ventajas de contratar una CRO
Externalizando la gestión de estos servicios, las farmacéuticas obtienen numerosas ventajas que, aunque estas son múltiples y se obtienen en función de las características del estudio, podríamos destacar las siguientes:
Monitorización en los ensayos
La monitorización es una actividad de vital importancia ya que asegura la seguridad de los animales (o pacientes en las investigaciones con humanos), la veracidad, fiabilidad y trazabilidad de los datos y la calidad de la investigación.
Al inicio del estudio (antes de que comience) se realiza una formación específica para el ensayo sobre: Protocolo, BPC, responsabilidades de cada parte, logística del estudio, recogida de la información, documentos fuente, fechas, archivos, …
Que los investigadores conozcan al completo las características del proyecto es imprescindible para evitar errores fatales en los datos.
Visitas periódicas a los centros de investigación: Estas visitas buscan asegurar el cumplimiento de las normas éticas, verificar la correcta inclusión de los animales sujeto de estudio y los datos registrados en los CRD (Cuadernos de Recogida de Datos),… Esto permite corregir a tiempo errores o incongruencias en los datos y revisar si se ha producido Acontecimientos Adveros (y si estos han sido notificados de acuerdo con los procedimientos establecidos). Estas visitas aseguran el correcto cumplimiento del protocolo.
La monitorización como garantía de la calidad de los datos: Es necesaria la comunicación periódica y continua con el investigador responsable de la limpieza y validación de los datos durante su tratamiento. Esto permite la eficiente resolución de incongruencias y errores, así como que se está llevando un correcto registro de “quién hace qué”.
Todas estas actividades, dichas de manera muy resumida y destacando lo principal, parecen rápidas o sencillas de hacer. Si así fuera, el concepto monitorización no existiría como tal dado que no sería necesario, ni estaría tan reglado o tendría un título en cada documento ya que se daría por hecho que se cumplen todas estas pautas implícitamente.
Tipos de CRO
Podemos distinguir los tipos de CRO en función de dos factores:
¿Qué me debo preguntar a la hora de elegir una CRO?
Lo primero de todo es tener en cuenta los objetivos de estudio, los aspectos técnicos y el presupuesto, para hacer primero una criba en cuanto a los dos aspectos que acabamos mencionar.
A posteriori, una CRO que pueda asesorar de manera personalizada en todas y cada una de las fases del proyecto (tamaño de muestra necesaria, diseño de protocolo, número de monitorizaciones, …) es un plus que muchas farmacéuticas cada vez valoran más. Para ello, es importante que la CRO se adapte a la forma de trabajar del promotor, cuente con la experiencia necesaria, y se involucre en la óptima ejecución del estudio.
Todo ello, desde la transparencia en sus actividades y costes y con una actitud proactiva para la resolución de incidencias.
Siguiendo el estudio que mencionábamos antes de PharmaIQ, la mayoría de las empresas que participaron en la realización afirmaron que la calidad de los servicios es el criterio más importante a la hora de hacer una selección (casi un 60%). En segundo lugar, destacaba la reputación y la experiencia que tenían en el mercado.
Nuestra empresa
Si has llegado hasta aquí, esperamos que hayamos podido clarificar las principales responsabilidades de las CRO y su papel en la industria. Nosotros llevamos más de 20 años realizando ensayos clínicos y nutricionales en animales de abasto, donde nuestro lema “exactitud y precisión” refleja nuestra metodología de trabajo.
Garantizar la seguridad alimentaria es nuestro principal objetivo.
Nos involucramos en todas las fases involucradas en los ensayos, desde el diseño del protocolo hasta la presentación del informe final, o en sólo algunas específicas (como por ejemplo el análisis de los datos o la definición del protocolo). Nos adaptamos a nuestros clientes, a los cuales siempre agradecemos la confianza en nuestra profesionalidad y buscamos la mejora continua para estar siempre actualizados tanto en normativa vigente como en técnicas innovadoras.
Contacta con nosotros para más información, estaremos encantados de atenderte.
Referencias
Henry, C. (2018, 27 marzo). Top 10 Clinical Research Organisations in the Pharma and Biotech Industry. Pharma IQ. https://www.pharma-iq.com/pre-clinical-discovery-and-development/articles/top-10-clinical-research-organisations-in-the